
2022 VINNOVA | 第七屆血管創新論壇
4月22日,第七屆血管創新論壇(VINNOVA 2022)在線上隆重召開,大會由中國研究型醫院學會血管醫學專委會、中國醫療器械行業協會血管器械分會、北京博瑞血管健康公益基金會共同主辦,數百名行業專家參與發言。
會議為臨床專家、科研院所、政策制定者、產業界搭建了交流平臺,共同探討血管疾病前沿技術和發展動態,為先行者提供探索的方向,通過業內跨界交流推動我國血管醫學領域的快速發展。
如何在合規框架下加速創新產品臨床試驗
奧泰康扎根創新醫療器械和高端醫療器械,提供臨床注冊全程解決方案。創新論壇中,中國醫學科學院阜外醫院-李衛教授的發言也為創新產品的臨床試驗設計提供了解決方案,在此,我們對李衛教授的講解進行了拓展解析。

李衛
中國醫學科學院阜外醫院
中國醫學科學院北京協和醫學院阜外醫院研究員、博士生導師,國家心血管病中心醫學統計部主任,法國生物統計學博士,香港中文大學公衛學院客座教授,中國醫療器械行業協會醫學數據分析專業委員會主任委員,中華醫學會心血管病分會信息化學組副組長,中國醫藥教育協會醫藥統計專業委員會常委,國家藥品監督管理局藥物及醫療器械審評專家,國家科技部、國家衛健委臨床研究審評專家,中國臨床試驗數據管理學組及統計學組成員,國際臨床試驗生物統計學組成員,主編或主譯臨床試驗統計方法學論著3部,在臨床研究設計及評價方面具有豐富經驗。
如何在合規框架下加速創新產品臨床試驗-視頻

PPT Page 1

PPT Page 2
2017年10月8日,為鼓勵藥品醫療器械科技創新,提高上市產品質量和產業競爭力,滿足公眾臨床需要,中共中央辦公廳、國務院辦公廳印發了《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》。在多方面深化了審批制度,包括改革臨床試驗管理、加快上市審評審批、促進藥品創新和仿制藥發展、加強藥品醫療器械全生命周期管理、提升技術支撐能力、加強組織實施等。
政策鏈接:關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見.doc
PPT Page 3
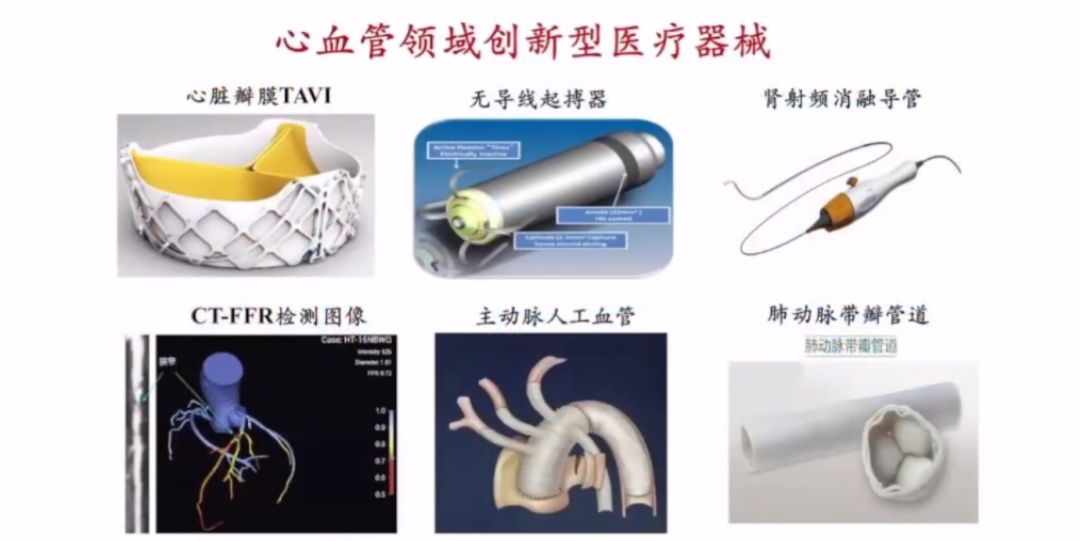
自政策實施以來,我國心血管領域有多款醫療器械通過創新審批,為臨床帶來新選擇,包括心臟瓣膜TAVI、CT-FFR等創新產品。

PPT Page 4
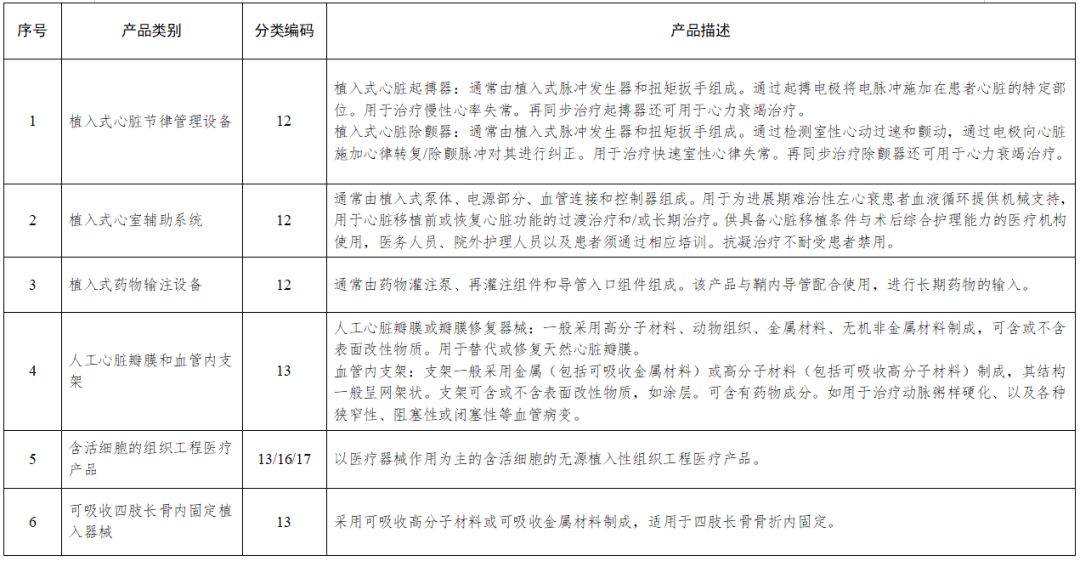
根據我國醫療器械分類,二類、三類要需要做臨床試驗,對人體具有較高風險的第三類醫療器械進行臨床試驗,應當經國務院藥品監督管理部門批準,拿到高風險醫療器械臨床試驗審批證明。列入《需進行臨床試驗審批的第三類醫療器械目錄》中的醫療器械應當在中國境內進行臨床試驗,包括:
●植入式心臟節律管理設備
●植入式心室輔助系統
●植入式藥物輸注設備
●人工心臟瓣膜和血管內支架、
●含活細胞的組織工程醫療產品
●可吸收四肢長骨內固定植入器械
政策鏈接:需進行臨床試驗審批的第三類醫療器械目錄(2020年修訂版).doc
《需進行臨床試驗審批的第三類醫療器械目錄》

PPT Page 5
2014年2月7日,為保障醫療器械的安全有效,鼓勵醫療器械的研究與創新,促進醫療器械新技術的推廣應用,推動醫療器械產業發展,國家藥監局制定了《創新醫療器械特別審批程序(試行)》,政策從創新產品定義、提交資料、證明性文件、等方面規定了創新器械審批流程和要點。

PPT Page 6
通過創新審批后,可享有審評部門早期介入、專人負責、提供指導、優先審評、加強溝通等諸多VIP待遇,為企業節約大量時間,縮短產品上市時間。

PPT Page 7
李衛教授講到,雖然是創新醫療器械,國家藥監局規定也要按照醫療器械臨床試驗相關規定的要求去執行,評價產品的安全性和有效性,創新政策的推出是為了加速審評過程,但不會降低審批標準。

PPT Page 8
2018年1月8日,國家食品藥品監督管理總局為貫徹落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),加強醫療器械產品注冊工作的管理,進一步提高注冊審查質量,鼓勵醫療器械研發創新,制定了醫療器械臨床試驗設計指導原則。原則中闡述了臨床試驗設計的基本類型及特點、受試對象、評價指標、比較類型和檢驗假設、樣本量估算等,為方案設計者提供依據。
政策鏈接:醫療器械臨床試驗設計指導原則.doc
PPT Page 9
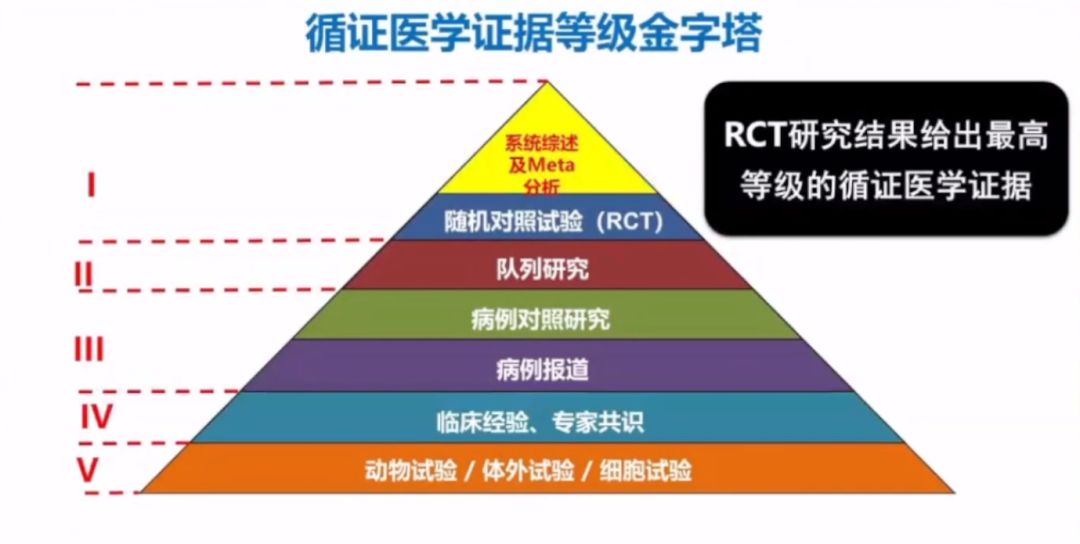
李衛教授表示,根據循證醫學證據級別金字塔中最高等級的I級證據顯示,基于良好設計的隨機對照試驗(randomized controlled trial,RCT)最能夠評價器械的安全性和有效性。

PPT Page 10
李衛教授總結到,以上市注冊為目的的創新型醫療器械臨床試驗需在符合倫理和臨床可行的情況下,應進行最高循證等級的前瞻性、隨機對照研究。

PPT Page 11
李衛教授講到,美國FDA針對全新的心血管長期植入器械,也要做前瞻性、隨機對照臨床試驗。創新產品無同類產品可對照,可與常規的藥物/手術治療比較的優效性設計,也就是最小負擔原則。
拓展學習:
●定義:
最小負擔原則,即“用最少量的必要信息,在適當的時間,以最有效的方式,恰當地解決相關監管問題或事項”。最小負擔原則適用于所有醫療器械及其全生命周期。
●主要內容:
①審評機構要求提供必要的最少信息,以充分解決當前的審評問題;
②企業在提交注冊申報資料時,應保證審評機構負擔最小;
③采用最有效的方法解決問題,如充分的溝通交流,或者制定補正通知書的指導原則,提出補正通知書的要素“證據、差距、原因、期望”,清晰、簡明地傳達審評要求、期望、過程、政策和決定以及背后的基本原理;
④在合適的時機提出合適的信息要求,如在合適和可行的情況下利用真實世界數據減少對臨床數據的要求;
⑤與技術相適應并充分考慮特殊的產品創新周期、證據需求及患者需求;
⑥在合理和可行的前提下利用和參考其他國家和地區的數據和監管部門決策;
⑦在實現國際醫療器械監管趨同和協調統一中應用最小負擔原則,如認可和使用國際和其他標準組織發布的標準。
●優點
應用最小負擔原則有利于減輕審評負擔,將有限的審評審批資源聚焦高風險產品,通過最有效的方式在最恰當的時機,利用最少量的必要信息進行有效監管,更好地促進最新的高質量、安全、有效和經濟的醫療器械快速應用于臨床。

PPT Page 12
很多情況下,若無同類產品和治療手段可做對照,單組目標值的試驗方法不失為一種替代、妥協性的研究設計方法。
拓展學習:
隨機對照臨床試驗( randomized controlled trial, RCT)是臨床研究的金標準,藥物/醫療器械臨床研究中,尤其是提供關鍵證據的臨床研究中一般均采用
RCT。在極少數的醫療器械臨床試驗中,如采用隨機對照試驗,會存在倫理學風險,致使臨床操作不可行。在此 情 況 下,單 組 目 標 值 ( single-arm objective per- formance criteria ,OPC) 臨床試驗不失為一種替代策略,為產品注冊提供關鍵證據。
文獻鏈接:單組目標值臨床試驗的統計學考慮.pd

PPT Page 13
在法規框架下進行創新產品的臨床試驗設計,李教授認為最關鍵的是適應癥的選擇問題(有無對照組),可設計出2個方案,以便和國家藥監局相關部門溝通。
●隨機對照(RCT):與常規治療手段比較。