
引言
前研系列「輕醫美」時代來臨,注射類醫美熱度不減,再生材料彰顯潛力??前言
近年來,醫療美容成為發展迅速的熱點領域,監管趨嚴、消費升級、顏值經濟、技術進步等因素共同推動醫美行業的快速發展。輕醫美項目憑風險低、創傷小、恢復期短成為當下熱門,其中注射填充類材料根據用戶需求持續更新,玻尿酸、肉毒素、骨性材料、羥基磷灰石、膠原蛋白、活性材料、再生材料等材料百花齊放,其中再生材料發展迅速且極具潛力,本篇帶大家了解注射類再生材料相關內容。
注射類占比逐年增加,有望成為醫美行業新增量
市面上將非手術類項目統稱為“輕醫美”,輕醫美項目包括注射類、光電類及其他項目,相較于傳統醫美項目,輕醫美項目憑風險低、創傷小、恢復期短成為當下熱門,在醫美市場中占據半數以上的市場份額。新氧顏究院數據顯示,2022年上半年,非手術類醫美占比達60.72%,占醫美整體市場一半有余。
隨著輕醫美市場的快速增長,微創注射類手術也在不斷地提升市場占比。頭豹研究院《2023年中國醫美再生注射劑行業概覽》預測,到2027年,中國大陸醫美再生注射劑市場空間可達到約115.2億元人民幣,2025-2027年期間復合增長率約為31.2%,持續升溫的醫美領域也驅動著注射類填充類材料的研發腳步。
從填充到再生,再生材料熱度增長最快
以玻尿酸、肉毒素為代表的物理填充,在注射醫美占比約為2/3、1/3,2021年國內再生針劑陸續獲批上市,包括長春圣博瑪及北京愛美客自主研發的兩款童顏針,以及華東醫藥通過收購英國Sinclair公司引進的少女針產品。
再生醫學作為科學及技術交叉應用的前沿醫學領域之一,在“十三五”“十四五”期間,一直被納入我國生物科技研發重點支持領域。方正證券數據顯示,我國再生醫美市場空間將在 2025 年增長到近30億元,持續保持每年20%以上的增長率,未來有望成為醫美注射市場的“頂流吸金獸”。新氧發布的《2022年中國注射類醫美行業分析報告》也顯示,注射細分賽道中再生材料填充熱度上升迅速。
應用場景拓寬,注射再生材料推陳出新
再生生物材料是再生醫學領域中起步較早、發展較迅速的細分賽道,已有多款產品上市,進口替代效應顯現。再生材料是能夠刺激人體纖維細胞和膠原蛋白再生的新型材料,注射后起到結構重塑和容積填充作用,達到抗衰目的,效果通常比玻尿酸更加持久。
近年來,得益于醫美行業技術更迭及醫美市場滲透率加快,再生材料的應用場景從醫療端逐漸拓展至醫美端,并推動醫美注射產品種類豐富和功效優化,醫美新材料上游市場進入更高質量的競爭階段,很多極具潛力的再生材料被用于醫美注射填充劑的研發,產品將用于糾正鼻唇溝、頸紋、淚溝、法令紋等。

絲素蛋白(Silk Fibroin,SF),作為天然的“再生類”填充材料,具有更為安全和高效的優勢,可達到即時填充和刺激膠原蛋白再生的效果,達到長期組織替代作用,其具有良好的生物相容性、細胞黏附特性、機械強度以及可調控的體內降解速率,目前已被廣泛用于生物醫學與組織再生等領域。
縱觀全球市場,早在1993年,絲素蛋白就已被美國食品和藥物管理局(FDA)批準用于生物醫學應用,通過了生物相容性和安全性測試并符合醫學標準。隨著再生類材料的熱度升高,諸多頭部企業也在積極布局絲素蛋白賽道,足以窺見絲素蛋白作為醫美注射填充針劑的發展潛力。
2021年6月,蘇州蘇豪生物材料科技有限公司研發的絲蛋白創面敷料獲得NMPA批準上市(蘇械注準20162140234),產品適用于非慢性創面的護理,臨床淺Ⅱ度、Ⅰ度燒傷創面的護理,系絲素蛋白首個二類注冊證。
2021年9月,Galderma與美國Sofregen Medical達成獨家戰略合作,共同開發基于蠶絲蛋白材料創新應用技術的新一代皮膚填充劑。
2022年1月,復銳醫療科技與復星醫藥旗下基金簽訂協議成立天津星絲奕生物科技有限公司,推進絲素蛋白透明質酸鈉復合凝膠的研發和生產。
2023年11月,新氧科技布局絲素蛋白透明質酸鈉復合溶液,以及細胞外基質生物注射凝膠共兩項再生品類的研發生產,夯實了再生賽道產品矩陣。
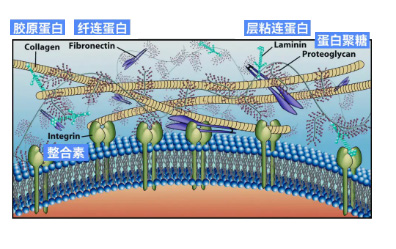
細胞外基質(extracellular matrix,ECM)是一類具有誘導組織修復與再生的天然材料,是細胞生存的微環境與細胞共同組成人體組織和器官,其由各種蛋白和多糖組成的復雜三維網絡結構,為組織和器官提供穩定的信號傳送和結構支持,不僅具有良好的生物相容性,還有極強的內源性組織誘導能力,非常適合細胞的黏附和生長,并在植入后調控和加速組織修復過程,可應用于填充組織缺失空隙、誘導組織再生、修復受損組織、完成周邊組織整合。
不同于其他材料,細胞外基質由細胞分泌,無論在結構上還是功能上都最接近人體細胞微環境,ECM因其能夠起到較好的修復和再生功效,而被認為是適用于再生醫學的新一代生物材料,在創面修復、美容護膚、抗衰老方面有巨大優勢。
2023年5月9日,湖北恒安芙林藥業股份有限公司取得國家藥監局批準的三類醫療器械注冊證(國械注準20233140615),系全國首個以細胞外基質來源的膠原蛋白為原料制備的三類膠原貼敷料。
2023年7月,圣至潤合(北京)生物科技有限公司的細胞外基質(ECM)生物凝膠產品完成臨床試驗全部受試者入組,系國內首個進入臨床的ECM醫美注射產品。
醫美產品臨床試驗增加,法規政策趨于完善
隨著注射類醫美產品研發熱度增加,產品上市前的臨床試驗也逐漸增多,國家藥監局相關政策不斷完善。
2022年3月30日
國家藥品監督管理局發布關于調整《醫療器械分類目錄》部分內容的公告,明確水光針(注射用透明質酸鈉溶液)按照三類器械監管。
2023年5月17日
 為進一步規范透明質酸鈉復合溶液產品臨床試驗,加強該類產品的監督管理,藥監局發布水光針臨床試驗技術審評要點,編制了《透明質酸鈉復合溶液臨床試驗技術審評要點(征求意見稿)》。
為進一步規范透明質酸鈉復合溶液產品臨床試驗,加強該類產品的監督管理,藥監局發布水光針臨床試驗技術審評要點,編制了《透明質酸鈉復合溶液臨床試驗技術審評要點(征求意見稿)》。
2023年12月11日
 為進一步規范面部注射填充材料產品上市前的臨床試驗,國家藥監局器審中心發布《面部注射填充材料臨床試驗注冊審查指導原則(征求意見稿)》,針對不用材料面部注射產品臨床試驗中的適用范圍、試驗設計、臨床評價指標、樣本量、入排標準等進行了規范。
為進一步規范面部注射填充材料產品上市前的臨床試驗,國家藥監局器審中心發布《面部注射填充材料臨床試驗注冊審查指導原則(征求意見稿)》,針對不用材料面部注射產品臨床試驗中的適用范圍、試驗設計、臨床評價指標、樣本量、入排標準等進行了規范。
結語
當下,新材料產業已然成為我國蓬勃發展的戰略性新興朝陽產業之一,生物醫用材料正處于從第一代傳統惰性材料向第三代組織再生材料快速過渡的關鍵時期,人們對面部抗衰的重視程度也使市場對原料本身提出了更高的要求,唯有順應時代發展趨勢的材料才能在加速變革的潮流中屹立不倒,滿足臨床的需求。