
01
引言
近年來,隨著醫療需求日益增長,醫療器械已成為我國生物醫藥產業中發展最迅速的細分行業,心血管類產品成為創新醫療器械特別審批通道的重點領域,其中介入治療技術發展迅速,2019年國內血管疾病患病數高達4.706億人,手術量高達133.88萬,隨著血管疾病患病率上升,手術量預計將以15.07%復合年增速增長,進而推動介入相關醫療器械需求量。
2020年4月,奧泰康助力【多分支人工血管覆膜支架系統】通過創新醫療器械審批,該醫療器械的誕生,為主動脈夾層疾病的治療提供了更加優異的選擇。
02
疾病背景
什么是主動脈夾層?
主動脈夾層是一種兇險的心血管急癥,由于主動脈管壁內膜出現破口,血液由此進入動脈壁中層,形成夾層血腫,并逐漸延伸剝離主動脈的內膜和中膜。患者出現刀割樣疼痛、惡心、嘔吐等癥狀,主動脈夾層需緊急醫學治療,一旦發病可能導致主動脈破裂,嚴重威脅患者生命安全。
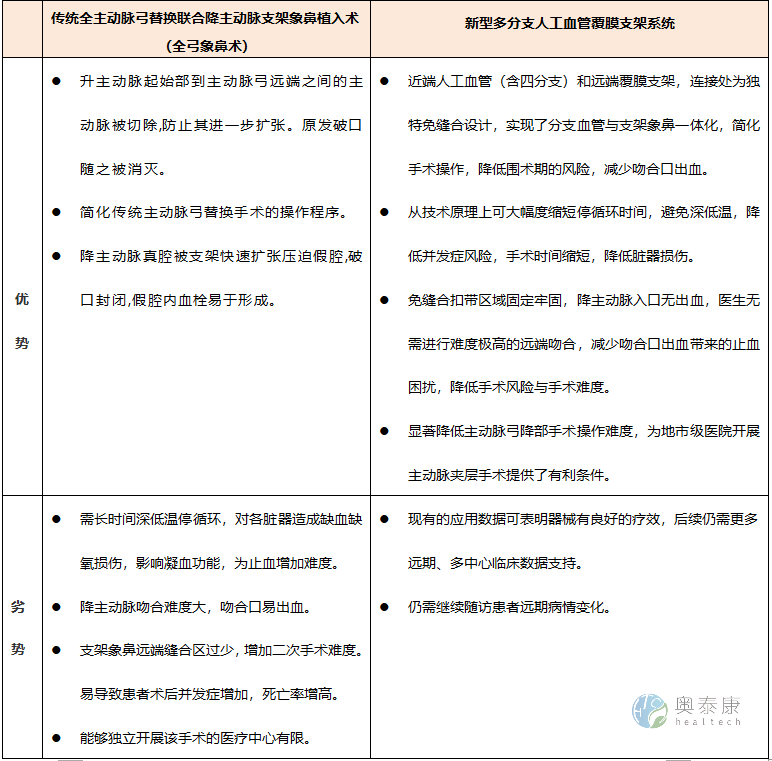
主動脈夾層是心血管疾病中死亡風險最高的疾病之一。臨床可分為Stanford A型和B型,其中A型死亡風險更高,發病48 h自然病死率高達50%。目前主動脈夾層的治療方案眾多,對于累及升主動脈或主動脈弓的主動脈夾層,仍以外科手術作為主要治療手段。隨著治療技術的不斷發展與經驗的累積,全主動脈弓替換聯合降主動脈支架象鼻置入術(簡稱全弓象鼻術)已成為國內外治療累及弓部主動脈夾層的標準手術方案。
雖然經典的手術方式在近15年間飛速發展,但仍存在諸多臨床弊端。隨著醫療產品研發技術突飛猛進,創新型醫療器械——多分支人工血管覆膜支架系統問世,彌補了傳統手術中的部分不足,為廣大患者帶來福音。
03
傳統主動脈夾層手術vs多分支人工覆膜支架系統手術的對比
04
奧泰康臨床注冊團隊助力【多分支人工血管覆膜支架系統】創新審批

目前處于二期多中心試驗入組階段,若試驗進行順利,產品有望于2022年獲得國家藥監局批準上市
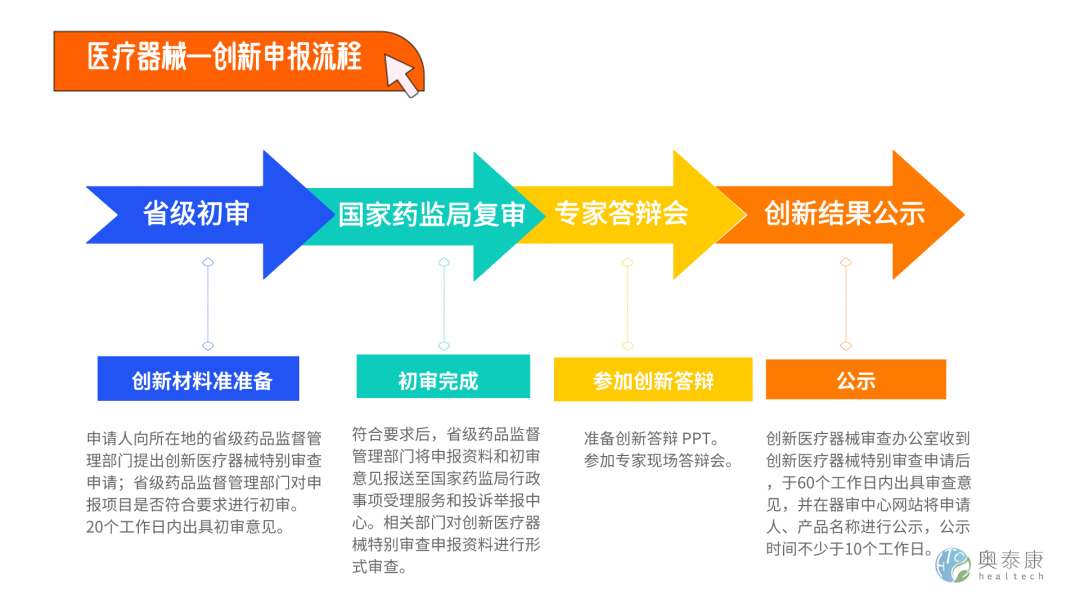
醫療器械的產品從研發定型到最后取得注冊證,整個流程動輒需要兩到三年甚至更長時間。為鼓勵醫療器械創新,促進醫療器械新技術推廣和應用,國家藥監局于2018年11月發布了《創新醫療器械特別審查程序》,為進一步深化醫療器械審評審批改革,保障醫療器械臨床使用需求,藥監局于2016年10月25日發布《醫療器械優先審批程序》。創新醫療器械特別審查程序和醫療器械優先審批程序是醫療器械審批兩大“綠色通道”, 一旦通過了創新審批,進入“綠色通道”,可享有審評部門早期介入、專人負責、提供指導、優先審評、加強溝通(包括檢測環節都能優先)等諸多VIP待遇,為企業節約大量時間,縮短產品上市時間,而產品通過創新通道審批,足以說明創新審查專家對申報產品創新性以及臨床價值方面的認可。
05
創新申報經驗分享
奧泰康在醫療器械注冊申報領域深耕細作,為客戶擔任創新醫療器械咨詢服務顧問,助力多項產品通過創新審批,逐步探索與發展過程中,我們梳理出3個容易影響審批失敗的環節進行逐一闡述。
● 知識產權情況及證明文件
① 未通過創新審批流程的產品,50%原因都與專利相關資料相關。
② 已授權的專利需盡快申請創新醫療器械特別審查,時間不得超過5年。
③ 專利主體人與申報主體需保持一致,專利持有人需是申報的主體。
④ 專利權利要求中,某一部分能體現新穎性和創造性即可,權利要求書中不用全部滿足。
⑤ 專利描述必須有應用場景,描述須具體,避免遺漏導致審批失敗。
● 產品創新性的證明文件撰寫需嚴謹
① 需與臨床專家深入討論,從專家角度溝通產品的創新意義,突出產品在臨床應用中的顯著價值,提高審批通過可能性。
② 重視臨床意義部分,需挖掘創新點,詳細深入寫明產品創新技術和工藝為臨床帶來的核心價值,不可照搬文獻使臨床意義浮于表面。
③ 審評專家對真實人體實驗數據感興趣,可進行1-2例人體試驗,獲得臨床數據,收集病例入院信息、圖片、手術數據結果,形成報告后再進行創新申報,有助于提高通過率。
● 創新答辯會注意事項
① 答辯PPT需體現團隊各方,包括研發、注冊等,展現研發實力和研究團隊既往成果,體現團隊成熟性和產品質量可控性。
② 可在會上播放動物實驗錄像、產品照片、DOMO視頻等,使專家更快熟悉產品,增加答辯通過率。
③ 會前一天需提前模擬答辯,控制答辯時間,擬好匯報思路,抓住匯報重點;測試好設備端口,保證設備穩定。
④ 答辯技巧上,盡量用數據與法規回答專家提問,避免用主觀推論或未加驗證的結論回答,保證專業性。
截至目前,已上市的117個創新醫療器械中,奧泰康完成的創新醫療器械申報項目有16個,占比13.68%。由于政策審批流程的嚴苛和市場準入門檻的提高,創新批件審批總體通過率不足20%,而奧泰康的通過率達100%,其中涵蓋心血管、AI軟件、神經外科、生物補片、導航系統等多個領域。